Metastasiertes kastrationsresistentes Prostatakarzinom
mCRPC
Study of Pembrolizumab (MK-3475) Combination Therapies in Metastatic Castration-resistant Prostate Cancer (MK-3475-365/KEYNOTE-365)
Welche Patientengruppe wird in die Studie eingeschlossen?
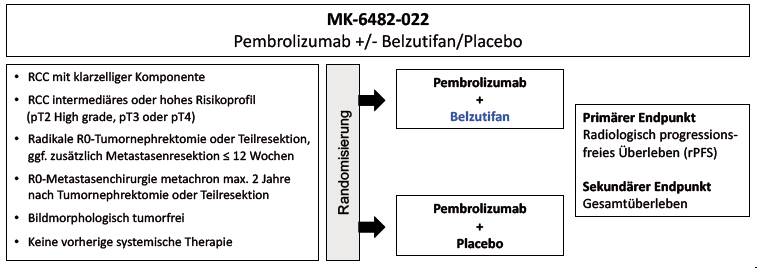
Patienten mit einem intermediären oder hohen Rezidivrisiko nach radikaler Resektion eines Nierenzellkarzinoms mit klarzelliger Komponente in den Tumorstadien pT2 high grade, pT3 oder pT4. Auch Patienten nach vollständiger R0-Metastasenentfernung können an der Studie teilnehmen. Alle Patienten müssen bildmorphologisch tumorfrei sein.
Welche Vortherapien sind erlaubt?
-
Tumornephrektomie oder Nierenteilresektion innerhalb von 12 Wochen vor Studieneinschluss
-
Metastasenresektion innerhalb von 12 Wochen vor Studieneinschluss und innerhalb von 2 Jahren nach der ursprünglichen Tumornephrektomie
Welche Vortherapien sind nicht erlaubt?
- Systemische Vorbehandlung mit TKI oder Checkpoint-Inhibitoren
Gibt es Ausschlusskriterien für die Studie?
- Zweittumor in den letzten 3 Jahren
- Intrakranielle oder ossäre Metastasierung
- Autoimmunerkrankungen
- Herzinfarkt oder Schlaganfall innerhalb von 6 Monaten vor Studieneinschluss
- Tumorthrombus-Rest in der Vena Cava
Wie funktioniert die Phase-III Studie?
In dieser Studie erhält jeder Patient eine Immuntherapie mit Pembrolizumab als Standard. Die zu prüfende Substanz Belzutifan wird in zwei verschiedene Therapiearme per Zufallsprinzip randomisiert. Dabei ist die Studie verblindet: Weder der Patient noch der Arzt wissen, ob die Kombination aus Pembrolizumab plus Belzutifan oder Pembrolizumab plus Placebo verabreicht wird.
Was für eine neue Tumortherapie wird untersucht?
Die zugelassene Immuntherapie mit Pembrolizumab führt zu einer Aktivierung des eigenen Immunsystems gegen die Nierenkrebszellen. Belzutifan ist ein HIF-2α-Inhibitor, der die Zellteilung von Tumorzellen sowie das Wachstum von Blutgefäßen in der Umgebung des Tumors hemmt und somit die Nährstoffversorgung des Tumors stört.
Wie ist die Studie aufgebaut?
Wo finde ich ausführliche Informationen:
www.clinicaltrials.gov
